Anvisa analisa uso de animais em pesquisa
dom, 27 de outubro de 2013 • 00:19 •
Saúde
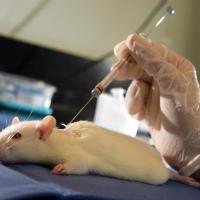
Todos os protocolos da Anvisa que tratam de pesquisas pré-clínicas estão sendo alvo de estudo. O objetivo, com esta análise, é que possam ser adotados métodos alternativos de pesquisa, in vitro, em substituição a alguns testes pré-clínicos realizados in vivo, dispensando o uso de animais. O uso de cobaias em estudos pré-clínicos será objeto de análise da primeira reunião do Conselho Científico da Anvisa, agendada para o mês de novembro, em data a ser divulgada.
A Anvisa tem o compromisso de prover medicamentos e produtos para a saúde que sejam seguros, que tenham qualidade e que sejam eficazes para as indicações terapêuticas para os quais são prescritos e que não provoquem efeitos colaterais adversos.
Para tal, a Anvisa segue regras que estão alinhadas com os protocolos das agências reguladoras internacionais de avaliação de risco sanitário.
A Anvisa tem regras de orientação e condução de estudos não clínicos (pré-clínicos) de segurança durante o desenvolvimento de medicamentos. Caso o pesquisador e/ou instituição consiga comprovar a segurança desses fármacos por outros estudos científicos e tecnicamente viáveis, os dados apresentados poderão ser validados pela Anvisa. O uso de métodos alternativos in vitro em substituição a estudos in vivo, desde que validados e aceitos internacionalmente, é recomendado.
Para avaliar a toxicologia e atestar a segurança e eficácia, uma das etapas das pesquisas prevê a realização de estudo não clínico, isto é, estudos que antecedem os estudos clínicos feitos em humanos.
Os estudos não clínicos podem incluir o uso de animais, quando não houver métodos alternativos que sejam eficazes ou que estejam validados para a segurança e a eficácia dos medicamentos que estão sendo testados.
Estes estudos devem ser conduzidos de acordo com a legislação nacional (Lei, decreto e Resoluções do CONCEA), as Boas Práticas de Laboratório (BPL) - OECD Principles of Good Laboratory Practice; HANDBOOK: GOOD LABORATORY PRACTICE (GLP) /WHO (Quality practices for regulated non-clinical research and development).
Testes não clínicos de toxicologia e segurança farmacológica são considerados necessários ao desenvolvimento de medicamentos e precedem a autorização de pesquisas clínicas, entretanto, não há uma determinação expressa de que tenham que ser feitos em animais, ou seja, a legislação nacional define que deve haver preferência pelos métodos alternativos ao uso de animais quando estes estiverem disponíveis e validados.
Fonte: Agência Nacional de Vigilância Sanitária



Comentários